
Vielfalt der Farne

©2010 Sabine Nittritz
Platycerium bifurcatum, er wächst epiphytisch in den Tropen, die Wedel werden ca. 1 m lang

©2012 Sabine Nittritz
Hymenophyllum spec. – ein Hautfarn mit nur einer Zellschicht

©2012 Sabine Nittritz
Blechnum novae-zelandiae. Er ist zwischen 20 cm und 2,50 m groß, die Wedel werden 8-60 cm breit.

©2012 Sabine Nittritz
Asplenium bulbiferum – ca. 40 cm hoch – Die kleinen hellgrünen Fiedern sind Kindel. Wenn man einen solchen Wedel auf der Erde ablegt, wachsen daraus neue Pflanzen.

©2017 Sabine Nittritz
Athyrium filix-femina Formen. Diese Farne sind wild aufgegangen.
Farne in Australien und Neuseeland

©2010 Sabine Nittritz
Dictymia brownii, Ost-Australien, er wird bis zu 60 cm lang und 2 cm breit, wächst auf Felsen und Bäumen

©2010 Sabine Nittritz
Drynaria rigidula, Basketfarn (Korbfarn). Zuerst werden die braunen Wedel entwickelt, die wie ein Korb herunterfallende Blätter usw. auffangen. In diesem Humus entwickelt sich dann der eigentliche Farn, der zwischen 60 cm und 1,20 m lange Wedel bildet. Er wächst an Felsen oder auch auf Bäumen (Australien)

©2010 Sabine Nittritz
Dicranopteris linearis, Australien, 10-80 cm hoch

©2010 Sabine Nittritz
Gleichenia dicarpa, ein kriechender Farn, der große Flächen bedecken kann, er bildet regelrechte Dickichte vor allem auf sumpfigem Boden

©2007 Sabine Nittritz
Microsorum pustulatum, 6-45 cm lang und 4-30 cm breite Wedel, er kriecht am Boden oder wächst epiphytisch auf Bäumen oder Felsen

©2010 Sabine Nittritz
Blechnum filiforme (Jugendwedel), er wird bis 25 cm groß, kriecht auf dem Boden bis er auf einen Baumstamm trifft. Dann fängt er an zu klettern und ändert sein Aussehen komplett

©2010 Sabine Nittritz
Die fertilen Wedel von Blechnum filiforme. Sie werden ebenso lang wie die sterilen Wedel

©2010 Sabine Nittritz
Adiantum aethiopicum, 20-50 cm groß, sehr filigran wachsend (Australien)

©2007 Sabine Nittritz
Asplenium australasicum, bis 1,50 m hoch und kann einen Durchmesser von 3 m erreichen

©2012 Sabine Nittritz
Blechnum filiforme, als ausgewachsene Pflanze, die Wedel werden bis 60 cm lang

©2008 Sabine Nittritz
Trichomanes reniforme, ein Hautfarn. D.h. er hat nur eine Zellschicht und wirkt dadurch durchsichtig. Er klettert in Bäume oder Baumfarne. Die Wedel werden zwischen 3 und 13 cm breit

©2008 Sabine Nittritz
Sticherus cunninghamii, er wird 20-50 cm groß und 15-30 cm breit. Er sieht ein wenig wie ein Regenschirm aus

©2008 Sabine Nittritz
Pyrrosia eleagnifolia, die Wedel variieren von rund bis länglich, 3-20 cm lang und 1-2 cm breit, er ist ledrig. Er wächst auf Felsen und auf Bäumen.

©2008 Sabine Nittritz
Polystichum richardii, schwarzer Schildfarn, er wird bis 35 cm groß
Weitere Bilder
Um einmal zu zeigen wie vielfältig das Aussehen von Farnen ist, sind hier verschiedene Wedelformen und -größen zu sehen.
Klima in Hauptherkunftsgebieten
Das Klima in den Hauptherkunftsgebieten unserer Farne aber auch für alle anderen Pflanzen
von Rolf Thiemann
Auf Grund der Tatsache, dass Europa im Vergleich zu anderen gemäßigten Zonen der Erde relativ arm an Pflanzenarten ist, stammt ein Großteil der Farne, die wir in unseren Gärten kultivieren, aus anderen Erdteilen. In vielen Fällen kennen wir die Ansprüche der einzelnen Arten nicht genau und fahren daher bei deren Kultur im Garten wie ein Schiff im Nebel.
Glücklicherweise nehmen es viele Farne mit ihren Ansprüchen nicht so genau und wir könen uns ohne Probleme im Garten an ihnen erfreuen. Einige andere jedoch wollen hier bei uns nicht recht gedeihen ohne dass wir uns dies erklären können. Manchmal kann es daran liegen. dass diese Farne so extrem gut an das Klima ihrer Heimat angepasst sind, dass sie mit unserem Klima nicht zurecht kommen.
Die meisten unserer ausländischen Farne stammen aus dem östlichen und westlichen Nordamerika, Nordostasien, südlichstem Südamerika und Neuseeland.
Wir neigen zu der Annahme, dass diese wie Mitteleuropa in der gemäßigten Zone liegenden Gebiete der Welt auch ähnliches Klima haben. Ähnlich ist es schon, aber nicht gleich.
Die Unterschiede wollen wir uns im Folgenden näher ansehen. Die Erkenntnisse können für uns manchmal bei der Kultur der Farne im Garten hilfreich sein.
DEUTSCHLAND
Um besser vergleichen zu können, wollen wir uns zunächst unser eigenes Wettergeschehen vergegenwärtigen:
Die geografischen Verhältnisse bedingen, dass nahezu alle Luftmassen der Umgebung ungehindert nach Deutschland einströmen können. Lediglich der Einfluss direkt aus dem Süden ist wegen der Alpen stärker eingeschränkt und auf Süddeutschland begrenzt. Von West kommt typischerweise kühle, feuchte Luft (ozeanische Luftmassen)im Winter bei 0 bis +5 Grad und Regen bis feuchtem Schnee, im Sommer bei ca. + 16 Grad und Regen.
Von Nordwest bis Nord kommt polare Kaltluft mit Schauern bei ca. 0 bis - 4 Grad im Winter und 8 bis 12 Grad im Sommer.
Von Nordost bis Ost kommen trockene kontinentale Luftmassen , im Winter sehr kalt bis unter - 25 Grd, im Sommer warm.
Geraten die ozeanischen und kontinentalen Luftmassen aneinander und vermischen sich, hat dies katastrophale Niederschläge zur Folge.
Von Südwesten kommen feucht-warme subtropische Luftmassen zu uns, die im Winter auch mal + 12 Grad oder mehr erreichen können. Im Sommer ist diese Luft oft unerträglich schwül-heiß.
Von Südosten wird seltener Luft herangeführt, meist als warme Luft im Sommer.
Typisch für unser Wetter ist daher die große Vielfalt und Unregelmäßigkeit der Wettererscheinungen. Kontinentales und ozeanisches Wettergeschehen wechseln ständig einander ab.
Unser Klima ist daher nicht eindeutig ozeanisch, aber auch nicht kontinental. Im Schnitt ist es als Übergangsklima zu bezeichnen, allerdings noch mehr zum Seeklima tendierend - im Nordwesten mehr, im Süden und Osten weniger.
Seeklima ist durch milde Winter und relativ kühle Sommer ausgezeichnet, kontinentales Klima durch kalte Winter und warme Sommer.
Die langjährigen Durchschnittstemperaturen bei uns liegen in Tieflagen je nach Gegend zwischen -2 bis +2 Grad im Januar und + 16 bis + 19 Grad im Juli.
Zum Vergleich: Dublin im Seeklima hat + 5 Grad Januardurchschnitt und + 15 Grad im Juli. Kiew im gemäßigten kontinentalen Klima hat einen Januardurchschnitt von - 6 Grad und einen Julidurchschnitt von + 20 Grad.
Wladiwostok im Berich des starken Kontinentalklimas hat im Januar durchschnittlich - 12,5 Grad und im Sommer + 20 Grad.
Ein weiteres Kennzeichen unseres Klimas, das auch für ganz Europa gilt, ist die durch den Golfstrom bedingte extreme Nordverschiebung der Klimazonen. Sie ist die größte Klimaanomalie der Erde. Nirgendwo anders ist es auf gleichem Breitengrad im Winter so warm wie bei uns.
Zum Vergleich: Auf gleicher Höhe wie Oslo oder Stockholm beginnt in Grönland das Inlandeis und auf der Höhe von Berlin beginnt im Bereich der Hudson Bay in Kanada die Tundra.
Östliches Nordamerika
Das mit dem unseren in etwa vergleichbare Klimagebiet im Osten Nordamerikas reicht etwa von der Südgrenze Virginias nordwärts bis Boston (Massachusetts ) und westwärts bis Tennessee, zum Mississippi und bis Chicago. Unterschiede zu unserem Klima bestehen zum einen darin, dass das genannte Areal wesentlich weiter südlich liegt als Mitteleuropa. New York nahe der Nordgrenze des bezeichneten Gebietes liegt auf der Höhe von Rom.
Die dadurch bedingte größere Kraft der Sonne heizt das Land im Sommer stark auf, mit einem Wort: Das Gebiet vereint die Wärme Italiens mit der Nässe Deutschlands. Zum anderen ist die Hauptzugrichtung des Wettergeschehens von Südwest nach Nordost. Dies führt feucht-warme Luft in das Gebiet, die, wenn sie Tennessee und Virginia erreicht hat, bereits 1000 km über Land gezogen ist. Im Winter hat sie sich bereits abgekühlt. Von Norden her kann im Winter auch sehr kalte kontinentale Luft vordringen.
Das Klima ist daher im Osten Nordamerikas im Sommer feucht-heiß und im Winter je nach Lage ähnlich kühl oder auch kälter als bei uns.
Im Südosten der USA in der Natur vorkommende Farne, deren Verbreitung nicht über Alabama, Georgia und Süd-Carolina nordwärts hinausreicht, sind in der Regel bei uns n i c h t winterhart.
Die Anpassung an die extrem warmen Sommer hat dazu geführt, dass sich die Pflanzen im Frühjahr viel Zeit mit dem Austrieb lassen können. Während bei uns die Natur bereits im März erwacht, ist es den "Amerikanern" meist bis April zu ungemütlich.
Die Farne aus dem Gebiet gehören daher meist nicht zu den früh austreibenden und damit besonders spätfrostgefährdeten Arten.
Westliches Nordamerika
Dieses zweite große "Farnzentrum" winterharter Farne Nordamerikas erstreckt sich längs der Pazifik-Küste etwa vom nördlichen Oregon nordwestwärts bis zu den Aleuten. Über die gesamte Strecke zieht sich eine hohe Gebirgsbarriere längs der Küste dahin, die trockene, im Winter sehr kalte Festlandsluft aus dem Inneren des Kontinents im Osten von der Küste fernhält. Umgekehrt hält es die feuchte Seeluft vom Inland ab. Alle Niederschläge müssen sich an den Küstenbergen abregnen.
Das Gebiet ist daher durch ausgeprägtes Seeklima gekennzeichnet mit milden Wintern und teilweise extrem hohen Niederschlägen, vor allem im "Pfannenstiel" Alaskas. Dort fällt im Winter so viel Schnee, dass die Schneegrenze im Sommer teilweise nur 250 Höhenmeter über der Waldgrenze liegt. Zum Vergleich: In den Alpen beträgt die Höhendistanz zwischen Wald- und Schneegrenze rund 1000 Höhenmeter.
Im südlichen Bereich ( Oregon, Washington, südliches British Columbia ) gibt es direkt an der Meeresküste in tiefen Lagen jedoch nur wenig Schnee. Die Temperaturen liegen hier meist über Null. Die genannte Abschirmung durch die Gebirge sorgt auch dafür, dass hier nur geringe Fröste auftreten, in Oregon bis ca. - 7 Grad.
Nach Norden zu wird es allmählich kälter. Wegen des warmen Alaska-Stromes, der hier im Nordostpazifik eine ähnliche - wenn auch schwächere - Rolle spielt wie bei uns der Golfstrom, ist es aber auch noch an der Südküste von Alaska und auf den Aleuten vergleichsweise wintermild.
Die auftretenden Tiefstwerte sind denen bei uns in etwa vergleichbar. 100 km landeinwärts sieht es dagegen schon ganz anders aus: Temperaturen von - 45 Grad C können hier nicht nur vorkommen, sie treten auch regelmäßig und über längere Zeit auf.
Auch im Süden wird es im Hinterland recht kalt: Im östlichen Oregon können auch - 30 Grad C und darunter erreicht werden.
Die Sommertemperaturen ähneln denen in Mitteleuropa, ebenso ist auch die Niederschlagsverteilung.
Farne, die nur im Küstenbereich von Kalifornien und Oregon vorkommen und nicht wenigstens bis Washington vordringen, sind in der Regel nur ungenügend winterhart.
Südlichstes Südamerika
Was über das westliche Nordameriak ausgeführt wurde, gilt weitgehend auch für diesen Bereich und das im Rahmen dieses Aufsatzes nicht gesondert behandelte Neuseeland. Die Südwinter sind auf Meereshöhe mild. In Punta Arenas schwanken die Temperaturen überwiegend zwischen - 1 bis + 4 Grad C. Die tiefste dort gemessene Temperatur betrug - 16 Grad C. Im dortigen Sommer ( Januar ) liegt die langjährige Durchschnittstemperatur bei + 10 Grad C.
In Neuseeland ist es im Winter noch etwas wärmer: In Strandnähe direkt an der Küste der Südspitze der Südinsel liegt das langjährige Wintermittel bei + 5 Grad C, was in Europa dem Küstenbereich von Irland bis Westfrankreich entspricht.
Die Winterhärte von Farnen, die hier nicht in die Hochlagen der Gebirge steigen, ist gering. Typisch ist dies für die Gattung Blechnum, die in der Südhemisphäre ihre Hauptverbreitung hat.

Blechnum filiforme
die breiten Wedel sind steril, die schmalen fertil
als "erwachsene" Pflanze klettert sie in Bäume
(auch nicht winterhart - leider )
Foto © 2013 Dietrich Nittritz

Blechnum discolor
wächst bis in eine Höhe von 900 m überm Meer
(leider nicht winterhart)
Foto © 2013 Dietrich Nittritz
Ostasien
Dieses Paradies der winterharten Farne reicht vom Himalya und den Hochgebirgen im Südwesten Chinas nordwärts bis Ostsibirien und von Kamtschatka über Sachalin, Korea, Nord- und Mitteljapan bis zu den hohen Bergen Taiwans. Markantes klimatisches Kennzeichen dieses Bereiches ist das Monsunklima: Im Sommer erwärmt sich die asiatische Landmasse und damit auch die darüber befindliche Luft, die aufsteigt und damit von den tropischen Meeren neue, feuchte Luft ansaugt, die ebenfalls aufsteigt und dabei die gespeicherte Feuchtigkeit als Regen verliert (Sommermonsun)
Im Winter kehr sich dieser Vorgang um. Jetzt strömt die kalte trockene Festlandsluft dem Meer zu. Die Winter sind daher sehr trocken und die Sommer sehr nass. Teilweise fallen im Sommer unvorstellbare Regenmengen, im Osthimalaya (Assam) bis zu 12.000 mm.
Im Vergleich:Am Feldberg in Schwarzwald fallen durchschnittlich 1.900 mm, am Brocken im Harz 1.800 mm im Jahr.
Die ausgeprägte Wintertrockenheit ist auf den japanischen Inseln und Taiwan gemildert, da die Luft über dem Meer Feuchtigkeit aufnimmt bevor sie die Inseln erreicht.
Einige Farne Ostasiens haben sich diesen Klimaverhältnissen besonders gut angepasst, insbesondere die Angehörigen der Gattung Cyrtomium. Sie müssen im Winter unbedingt trocken stehen, wollen aber im Sommer gleichmäßige Feuchtigkeit haben. Beides - Winternässe und Trockenheit im Sommer - kann diese Farne umbringen.
Etwa nördlich des 40. Breitengrades (entspricht bei uns in Europa etwa der Linie Madrid - Mallorca - Sardinien) wird es im Winter sehr kalt. Es sind die Gebiete von Sachalin, Kamtschatka, Mandschurei und Japans Nordinsel Hokkaido. Weiter südlich wird es schnell milder. Die Winter in Korea und im Nordteil der japanischen Hauptinsel Honschu (Hondo) sind mit den unsrigen am ehesten vergleichbar. Weiter nach Süden werden Fröste in der Ebene schwächer und seltener. Tokio hat bereis ein Januarmittel von + 5 Grad C. Hier beginnt die Winterhärte grenzwertig zu werden.
Die japanische Insel Kyuschu ist bereits subtropisch. Was dort nur in der Ebene vorkommt, ist in der Regel bei uns nicht winterhart. Subtropisch ist auch der gesamte südchinesische Bereich ( Hunan, Yünnan, Zetschuan) und der Himalaya.
Alle bei uns im Freien kultivierbaren Farnarten (und natürlich auch alle anderen Pflanzen) aus diesen Gebieten stammen daher aus den dortigen Hochlagen. Als Faustregel kann gelten, dass Farne, die dort in Höhen über 3.000 m vorkommen, bei uns hart sind.
Man kann daher leider nicht nur aufgrund der Herkunft eines Farnes auf seine Härte schließen, sondern muss versuchen, auch Angaben über seine Höhenverbreitung zu bekommen.
Im Sommer wird es wegen der südlichen Breite auch in höheren Lagen recht warm. Der Osthimalaya liegt auf gleicher Höhe mit Florida und dem Persischen Golf. Viele ansonsten recht winterharte Farne lieben daher im Sommer etwas Wärme. Häufig treiben sie deswegen (und auch wegen der Anpassung an den meist erst im Juni einsetzenden Monsun) spät aus.
Bei anhaltend kaltem Sommerwetter wachsen sie bei uns im Schneckentempo und bleiben auch kleiner als in warmen Sommern.
Als typisch für dieses Verhalten sei hier Dryopteris sieboldii genannt.
Ähnliches gilt in abgeschwächter Form für Farne aus dem sommerwarmen Südosten der USA. Als Beispiel au diesem Raum sei hier Dryopteris ludoviciana genannt.
Überhaupt haben Nordostasien und das östliche Nordamerika klimatisch vieles gemeinsam: sehr warme, feuchte Sommer und kalte Winter. Nur die Winterfeuchtigkeit ist im Osten Nordamerikas höher.
Diese Gemeinsamkeiten führen zu dem Paradoxon, dass einige Farne in Ostasien und im östlichen Nordamerika vorkommen, nicht jedoch im dazwischen gelegenen (ozeanischen) pazifischen Nordamerika.
Ein Beispiel für diese Florengemeinschaft ist Onoclea sensibilis, der Perlfarn.
Plädoyer für eine "Arten(er)Findung" mit Augenmaß
von Wolfram Gaßner
Seit einigen Jahren beobachte ich mit Unbehagen, wie einige Pteridologen - die sich im übrigen sehr um die Erforschung der Farne verdient gemacht haben - in mancher Hinsicht zunehmend über das erklärte Ziel des Forschers hinausschießen , nämlich die natürliche Ordnung der Arten zu entschlüsseln und praxisnah darzulegen.
Es kommt mir etwas vor wie: Das Terrain ist tausendfach durchforstet und nahezu 'abgegrast' - da schaffe ich mir einfach 'Neuland' als Betätigungsfeld und Berechtigung meines Forscherdaseins. Und so werden dann von Botanikern der Löwenzahn, die Brombeere, der Rotschwingel und manche Weidenarten in teilweise Dutzende neue 'Arten' (oder 'Unterarten') aufgesplittet.
Eklatantestes Beispiel bei den heimischen Farnen ist Dryopteris affinis.
Der augenscheinliche Grund: Die Art ist apogam, alle Individuen sind identisch, es sei denn, es ereignet sich einmal eine Mutation, was selten vorkommt. Die Nachkommen dieser Mutante sind wiederum allesamt identisch. Dies hat zur Folge, dass die Art Dryopteris affinis aus einer Ansammlung von im Laufe von tausenden von Jahren und Generationen als überlebensfähig selektierter Klone besteht.
Der "Vorteil" für den "splittenden Farnforscher": Es gibt mehr oder weniger große einheitliche Populationen zu jedem Typ, die homogen sind und sich ohne Zwischenformen von anderen Populationen abgrenzen.
Dieser "Vorteil" entfällt bei sich sexuell fortpflanzenden Arten, weshalb auch niemand auf die Idee kommt, hier mit Splitting anzufangen, obwohl die Variabilität z.B. bei Polystichum aculeatum und setiferum mindestens ebenso groß ist wie bei D. affinis. Nimmt man die z.T. in der Natur gefundenen und weitergezüchteten Kultivare hinzu, so übertrifft deren Vielfalt diejenige von D. affinis sogar bei weitem, insbesondere, wenn man an Veränderungen wie beispielsweise die Brutbulbenbildung denkt, für die sicherlich eine ganze Reihe von Genen mutiert sein müssen!
Aber auch andere heimische Arten weisen eine hohe Variabilität bzw. optische Heterogenität auf, z.B. Athyrium filix-femina, Dryopteris dilatata und Polypodium interjectum. Ganz zu schweigen von Cystopteris fragilis.
Auch dass es von D. affinis verschiedene Ploidiestufen gibt, rechtfertigt keine Artenaufspaltung. Unterschiedliche Ploidiestufen sind von etlichen Farnen bekannt, bei denen glücklicherweise die Zugehörigkeit zu nur einer Art nicht bestritten wird. Es würde auch kein Mensch auf die Idee kommen, ein durch künstliche Chromosomenverdoppelung erzeugtes Individuum - wie es in der Pflanzenzüchtung nicht selten vorkommt - als neue Art zu beschreiben. Und das, obgleich damit sogar eine Grunddefinition des Artbegriffs bewusst außer Acht gelassen wird, nämlich die uneingeschränkte fertile, sexuelle Fortpflanzungsfähigkeit der Nachkommen (üblicherweise sind die triploiden Nachkommen einer Kreuzung aus diploid x tetraploid nämlich steril - und die Sterilität von Nachkommen ist wiederum ein Kriterium dafür, dass die Eltern nicht einer Art angehören).
Apropos Artdefinition:
Ein riesengroßes Defizit in der "splitting-Arbeit" und allgemein der Beschreibung neuer Arten ist: Es wird die Artdefinition nicht überprüft, weil es kompliziert ist, noch mehr bei Farnen und erst recht bei apogamen Arten.
Eine Art wird wie folgt definiert: Wenn die Nachkommen von zwei Individuen einer sich ähnelnden Gruppe von Lebewesen wieder den Eltern ähneln und sich wiederum bei Weitergabe der Fertilität mit beliebigen Individuen der Gruppe fortpflanzen können, dann gehören diese Individuen zu einer Art.
Bei (höheren) Tieren einschließlich de Menschen ist dieser Test noch vergleichsweise einfach. Man ,muss meist nur Männchen und Weibchen eine Zeitlang zusammensperren und irgendwann "passiert" es.
Ich habe jedoch noch nie von einem Farnforscher gehört oder gelesen, der einen entsprechenden Arttest zur Verifizierung seiner Vermutung durchgeführt hätte. Ein großes Manko ! Eine solche Überprüfung würde sicher die Artenzahl insbesondere der ostasiatischen Farne, von denen etliche apogam sind und die dem Farnsammler im eigenen Garten doch oftmals allzu ähnlich erscheinen, spürbar reduzieren.
Schaut man über den europäischen Tellerrand hinaus, wir die Sache mit D. affinis noch haariger. So geht diese Art über viele Zwischenstufen nahtlos in D. wallichiana über, wenn man von Mitteleuropa zum Himalaya wandert.
Noch schlimmer: Ich habe Typen von D. affinis aus den Alpen im Garten, die - würde ich sie in eine Mischpflanzung verschiedener Typen von D. wallichiana integrieren - kein Pteridologe sicher herausfinden könnte, würde ich ihnen verbieten, nach dem mehr oder weniger schwach ausgeprägten dunklen Fiederstielansatz zu schauen. (Übrigens habe ich auch schon D. affinis in der Wildnis gefunden, bei denen diese Pigmentierung praktisch nicht vorhanden war, jedenfalls nicht mehr als auch bei manchen D.wallichiana).
Ganz schlimm wird es, zieht man in die Betrachtung noch weitere apomiktische Arten aus dem D.wallichiana-Komplex hinzu, die z.T. D.affinis so ähnlich sehen, dass sie "hier im Wald kaum auffallen würden ", wie D. neorosthornii, redactopinnata, yigongensis oder xanthomelas. Diese Arten beinhalten alle ebenfalls die "Klon-Problematik"!
(Hierzu sei die vielleicht ein wenig polemische Bemerkung gestattet: Diese Arten ähneln sich untereinander erheblich mehr als viele Kulturpflanzen-Arten in sich, man denke nur an Tomaten, Bohnen, Äpfel oder gar Kohl).
Und schaut man über den Atlantik hinüber: D. pseudo-filix-mas aus Mexiko ist optisch zumindest makroskopisch identisch mit einem D.affinis-Typ aus dem Tessin, bis hin zur ausgeprägten Wintergrünheit. Bei mir im Garten unterscheiden sich beide nur darin, dass der Mexikaner 1 - 2 Monate länger noch einzelne Wedel nachschiebt - eindeutig eine lokale Anpassung an das mexikanische Klima und als Merkmal nicht einmal tauglich, um auch nur eine Varietät abzugrenzen!
Übrigens haben die großen Farnforscher schon vor 150 Jahren festgestellt, dass D. wallichiana erstaunlicherweise nicht nur in Asien, sondern auch in Mittelamerika vorkommt. Warum soll das denn nicht auch die "Schwesternart" D. affinis geschafft haben - die Distanz wäre sogar noch kürzer.
Noch ein Letztes:
Wünschenswert und hilfreich wäre es auch, gärtnerische Erfahrungen mit einzubeziehen. Manchmal werden zwei geographisch weit entfernte Arten sich sehr - zu? - ähnlich, wenn sie im Garten unter gleichen Standortbedingungen kultiviert werden.
Ein krasses Beispiel, von dem ich im übrigen selbst nicht weiß, was ich davon halten soll:
Ich habe Asplenium cuneifolium von absolut vertrauenswürdigen Spezialisten bekommen (und obendrein selbst identifiziert), einmal aus Sachsen, einmal aus Österreich. Im Garten wurden beide Herkünfte dem A. adiantum-nigrum sehr ähnlich, so wie auch aus Sporen gezogene Nachkommen dieser A. cuneifolium, die im Falle der sächsischen Herkunft vom gleichen Spezialisten "eindeutig" als A.adiantum-nigrum identifiziert wurden (was ich im übrigen nachvollziehen konnte).
Die österreichische Herkunft war ebenfalls nicht mehr von einem schlanken Typen von A. adiantum-nigrum zu unterscheiden. Die gleiche Erfahrung machte eine Farnsammlerin aus Mittteldeutschland.
Die vielzitierte Wintergrünheit von A, adiantum-nigrum versus Sommergrünheit bei A. cuneifolium taugt als diagnostisches Merkmal überhaupt nichts. Sie ist lediglich abhängig von der Länge und Strenge des Winters - und die sind nun mal im Verbreitungsgebiet von A. cuneifolium ausgeprägter. In milden norddeutschen Wintern und vor allem im Frühbeetkasten ist A. cuneifolium genauso gut wintergrün wie A. adiantum-nigrum!
Eindeutige Unterschiede betreffen die Winterhärte und Winternässeempfindlichkeit - ein gängiges Phänomen im Vergleich einer ozeanischen und einer kontinentalen Art.
Mein Appell an alle "splittingversessenen" Pteridologen:
Bitte haltet Euch zurück und rudert zurück!
Verkompliziert nicht einen natürlichen Sachverhalt und - ganz wichtig - erstellt nicht eine falsche Darstellung eines natürlichen Bildes!
Wenn Ihr neue Taxa von apomiktischen Arten wie D. affinis ausweisen wollt, dann macht es als "Forma" oder "Varietas" in ganz wenigen 'gravierenden' Fällen als "Subspecies" - doch nieals als neue Art ("Species"), wenn nicht im mindesten die Artdefinition (s.o.) gewissenhaft und belastbar überprüft wurde!
Und nicht zuletzt: Hinterfragt die Sinnhaftigkeit dessen, jeden Klon erfassen und benamen zu wollen, denn darauf liefe es schlussendlich hinaus.
Generative Vermehrung an vegetativ entstandenen Adventivprothallien
Text und Bilder: ©2018 Siegfried Piller
Diese Arbeit beschreibt den Verlauf eines Versuches, an dessen Ende es nachweisbar erscheint, dass den evolutionsbiologisch einfachen, thallösen Pflanzen mehrere Optionen zur Vermehrung zur Verfügung standen. Hier am Beispiel der ersten Generation der leptosporangiaten Farnpflanzen, dem Prothallium. Wird ein Prothallium mechanisch zerstört so wachsen an den, vom Scheitelmeristem getrennten, thallösen Gewebebruchstücken, Adventivprothallien. Diese sind mit weiblichen und männlichen Gametangien ausgestattet, also zur sexuellen aber apomiktischen Vermehrung fähig.
Vorwort
Dieter E. Meyer veröffentlichte im Dezember 1952 eine Arbeit mit dem Titel:
Über das Verhalten einzelner, isolierter Prothalliumzellen und dessen Bedeutung für Korrelation und Regeneration.
In dieser Arbeit schildert D. E. Meyer, wie an zerschnittenen Prothallien auf Agar mit entsprechenden Nährmedien Adventivprothallien wachsen. Er schließt daraus, dass diese aus einzelnen, vom Scheitelmeristem enthemmten Zellen an der Peripherie des Prothalliums entstehen. Durch Herauslösung einzelner Zellen aus dem Korrelationszusammenhang der Pflanzenbildung werden diese zur eigenen Teilungsgesetzlichkeit befähigt.
Wie sich diese Adventivprothallien in seinem Labor weiterentwickelten, wird in seinem Aufsatz nicht geschildert.
Hier setzt meine Arbeit an. Unter gärtnerischen Bedingungen soll geklärt werden, was aus solchen Adventivprothallien (Kurzform Adventhallien) werden kann und wie sie ausgestattet sind. Begleitet wird der Text von mikroskopischen und einfachen Fotographien die nicht bilderbuchtauglich sind, sondern als Arbeitsfotos zur Anschauung und zum Nachweis des Sachverhaltes zu verstehen sind.
Material und Methoden
Verwendet werden Klarsicht- Kunststoffbehälter (Salatschälchen) als Anzuchtschalen, zur Hälfte gefüllt mit normaler aber salzarmer, gärtnerischer Anzuchterde. Diese wurde zuvor in einem Papierfilter mit kochendem Wasser desinfiziert.
Vor der Belegung mit dem Versuchsmaterial wurde die Oberfläche des Substrates mit ebenfalls desinfiziertem weißem Filterpapier belegt (Teefilter). Das Substrat wurde so nass gehalten, dass sich das vollgesaugte Filterpapier durch Eigengewicht glatt auslegt.
Dies geschah zur besseren und sauberen Handhabung des Pflanzenmaterials und als geeigneter Hintergrund für die photographische Dokumentation.
Diese wurde mit einer einfachen Digitalkamera (Coolpix 5900) durchgeführt, zum Teil unter Zuhilfenahme eines Lichtmikroskopes. Zur Vorbereitung auf die mikroskopische Untersuchung wurden die vorgefärbten Prothallien zwischen zwei Möhren- bzw. Karottenscheiben gelegt und mit einem Schlittenmikrotom auf 30 µ (0,03 mm) geschnitten.
Das Pflanzenmaterial stammt aus eigener Aussporung. Verwendet wurden Prothallien aus Diplosporen von Polystichum setiferum `Dahlem´ und von Polystichum aculeatum × P. munitum F² (der 2. Generation von P. × arendsii). Dieses um zu beobachten, ob der unterschiedliche Ploidiegrad der Versuchspflanzen in den Ergebnissen eine Rolle spielt. P. setiferum gilt als diploide, P. × arendsii F² als hexaploid.
Das Experiment wurde unter natürlichem Licht bei einer Raumtemperatur von 22 bis 24° C durchgeführt.
Es wurden insgesamt 4 Tests in Folge durchgeführt.
Test 1, die 1. Generation Adventivprothallien von Prothallien aus Meiosporen
Bild 01 zeigt die Ausgangssituation. Die Substratoberfläche der Pflanzschale, ca. 7 x 5 cm groß, ist in 4 Sektionen aufgeteilt und wie folgt belegt: Links unten wurden Blätter von Erstlingswedeln des Polystichum setiferum `Dahlem´ ausgelegt. Es soll festgestellt werden, ob sich diese in ähnlicher Weise wie die Prothallienabschnitte verhalten.

Bild 01: Anzuchtschale am 1.Tag
Links oben im Bild 01 liegen Prothallienabschnitte des Polystichum setiferum `Dahlem´. Dazu wurden von mehreren Prothallien die Flügel abgeschnitten und diese noch weiter zerteilt. Die Mittelteile der Prothallien wurden verworfen.
Auf der rechten Seite liegen in beiden Sektionen Prothallienabschnitte des Farns Polystichum × arendsii F², die in gleicher Weise wie oben beschrieben zugeschnitten wurden. Die folgenden Bilder 02 und 05 zeigen jeweils die Veränderungen im Überblick.

Bild 02: Anzuchtschale nach 40 Tagen

Bild 03: Schon nach 26 Tagen sind bei 20 facher Vergrößerung deutliche Auswüchse an den Rändern der selbst nur ca. 1 mm² großen Prothallienabschnitte von Polystichum × arendsii F² zu sehen.

Bild 04: Adventhallien nach nur 26 Tagen, bei 20 facher Vergrößerung auch an Prothallienabschnitten von Polystichum setiferum `Dahlem´.

Bild 05: Anzuchtschale nach 94 Tagen
Die Zerstörungen in Bild 05 sind auf die Entnahme von Prothallien für mikroskopische Untersuchungen zurückzuführen.
Nachdem die Adventhallien eine Größe von ca. 5 bis 6 mm erreicht hatten (Bild 06), wurden einige entnommen und mikroskopisch untersucht.

Bild 06: Reife Adventivprothallien von Polystichum × arendsii F² nach 59 Tagen.
Zu diesem Zweck wurde der mittlere Teil der Adventivprothallien mit Hilfe eines Schlittemikrotoms in ca. 30µ starke Scheiben geschnitten. Diese Schnitte wurden leicht angefärbt um den Kontrast zu erhöhen, präpariert und anschließend mit einem Lichtmikroskop untersucht.
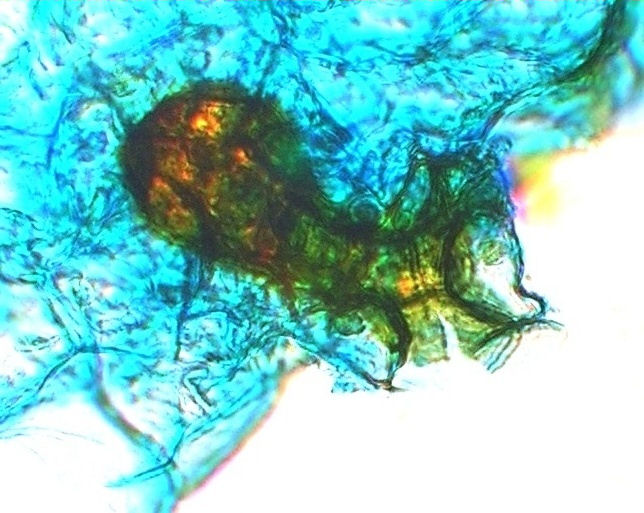
Bild 07: Archegonium von einem Adventhallium des Polystichum × arendsii F² nach 74 Tagen in 400 facher Vergrößerung.
Die Archegonien sind mit Ihrer Eizelle tief im Gewebe des Thallus eingebettet und schauen nur mit ihrem "Muttermund" heraus.
Sie sind in einem geglückten Schnitt gut zu erkennen. Die deutlich kleineren Antheridien sitzen wie dunkle Kristallkügelchen nur wenig eingebettet an der Oberfläche des Gewebes. Sie werden beim Vorgang des Schneidens meistens zerstört. Man findet sie zuverlässiger und in größerer Zahl in einem sogenannten Quetschpräparat als dunkle Punkte.

Bild 08: Antheridien von einem Adventhallium des Polystichum × arendsii F² nach 74 Tagen in 400 facher Vergrößerung.
Ähnliche Fotos konnten auch von Polystichum setiferum `Dahlem´ dokumentiert werden.
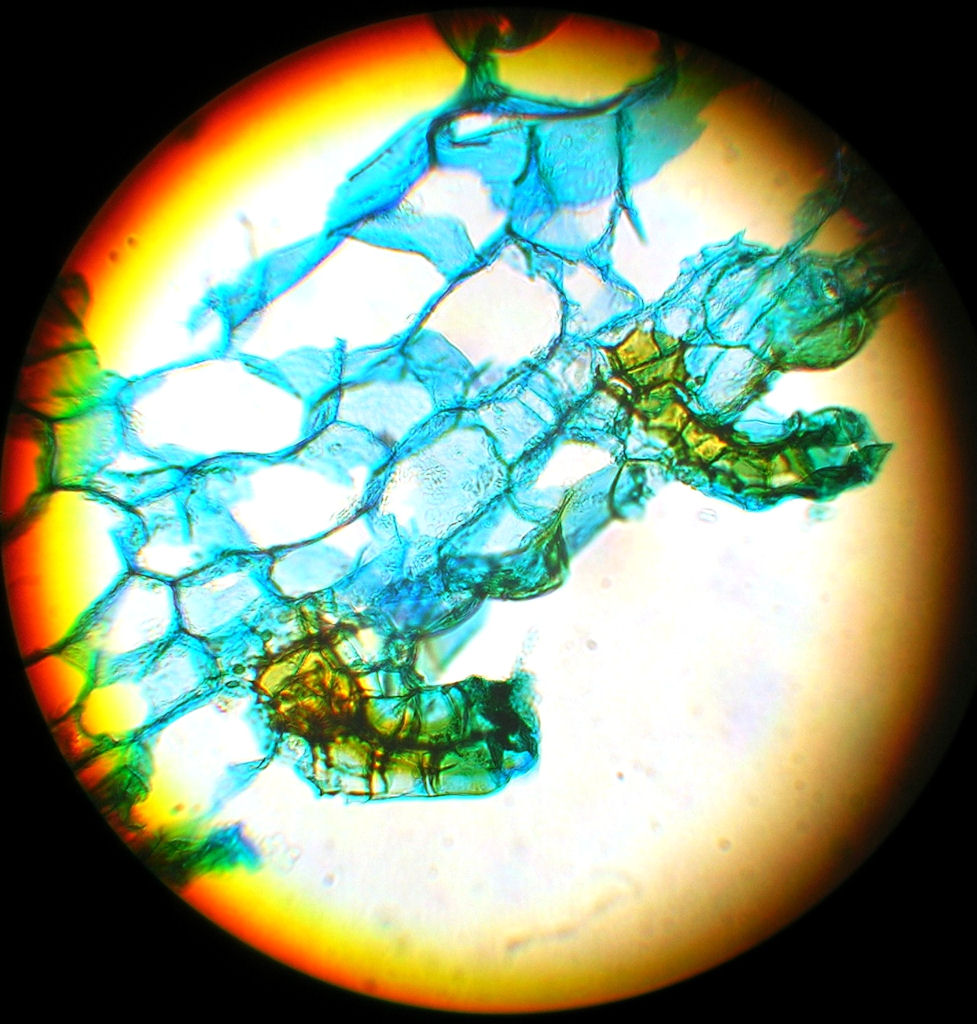
Bild 09: Archegonien von einem Adventhallium des P. setiferum `Dahlem´ nach 75 Tagen in 320 facher Vergrößerung.

Bild 10: Erste Sporophyten an Adventhallien des Polystichum × arendsii F² nach 114 Tagen.
Damit ist erwiesen, dass Adventhallien dieser beiden Farnarten sich ganz normal intra- und intergametisch befruchten können. Da die Ausgangprothallien haploider Art waren, wachsen daraus wieder Farne mit dem ursprünglichen, doppelten Chromosomensatz, also original Klone.

Bild 11: Pikierfähige Sporophyten aus diesen Adventhallien nach 301 Tagen. Links oben deutlich größer Polystichum setiferum `Dahlem´, rechts Polystichum × arendsii F².
Von jeder Sorte wurden 3 Stück eingetopft, zur morphologischen Kontrolle in ca. 3 Jahren.
Adventivprothallien von den Erstlingswedeln konnten nicht mit Sicherheit festgestellt werden.
Dieser Test 1 begann am 01.01.2018 und endete vorerst am 18.11.2018.
Test 2, die 2. Generation Adventivprothallien - Adventiv von Adventiv
Bild 12 zeigt wieder die Ausgangsituation. Die Substratoberfläche der Pflanzschale ist wieder in 4 Sektionen aufgeteilt und wie folgt belegt:
Links unten wurden Blattabschnitte von Erstlingswedeln des Polystichum setiferum `Dahlem´ ausgelegt. Nachdem der 1. Versuch unbefriedigend verlief, soll hier noch einmal festgestellt werden, ob sich überhaupt Adventhallien bilden.

Bild 12: Testschale 2 mit frisch ausgelegten, zerrissenen Adventhallien aus Test 1.
Links oben liegen Prothallienabschnitte des Polystichum setiferum `Dahlem´. Auf der rechten Seite liegen in beiden Sektionen Prothallienabschnitte des Farns Polystichum × arendsii F².

Bild 13: Testschale 2 nach 48 Tagen.
Im Gegensatz zum Test 1 wurden die Prothallienflügel nicht weiter zerschnitten, sondern in kleine Stücke zerrissen. Der Gedanke war, dass auf diese Weise vielleicht mehr unverletzte Randzellen zur Verfügung stehen als bei geschnittenen Kanten. Alle verwendeten Pflanzenteile stammen aus dem Test 1.

Bild 14: Testschale 2 nach 191 Tagen.
Einige Adventhallien wurden für die mikroskopische Untersuchung entnommen. Durch starke Rhizoidenbildung werden die Konturen der Adventhallien teilweise überdeckt.
In diesem Stadium muss, durch Zugabe von Wasser, das Schwärmen der Spermatozoiden provoziert werden.
Im Bild 14 Mitte- links sieht man den Wedel aus einem Adventhallium von Erstlingswedelabschnitten des Polystichum setiferum `Dahlem´. Die Ausbeute ist zwar deutlich geringer, grundsätzlich ist damit aber erwiesen, dass auch aus Erstlingswedeln Adventivprothallien gezogen werden können.

Bild 15: Testschale 2 nach 292 Tagen
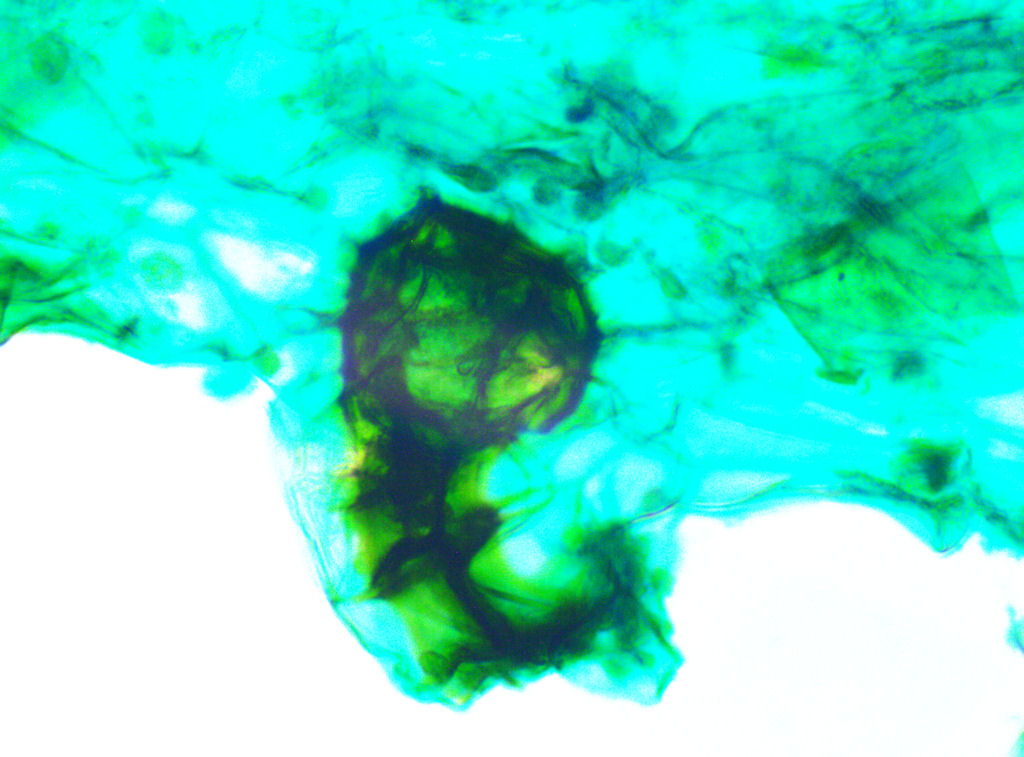
Bild 16: Mikroskopische Untersuchung nach 140 Tagen. Archegonium bei 320 x.
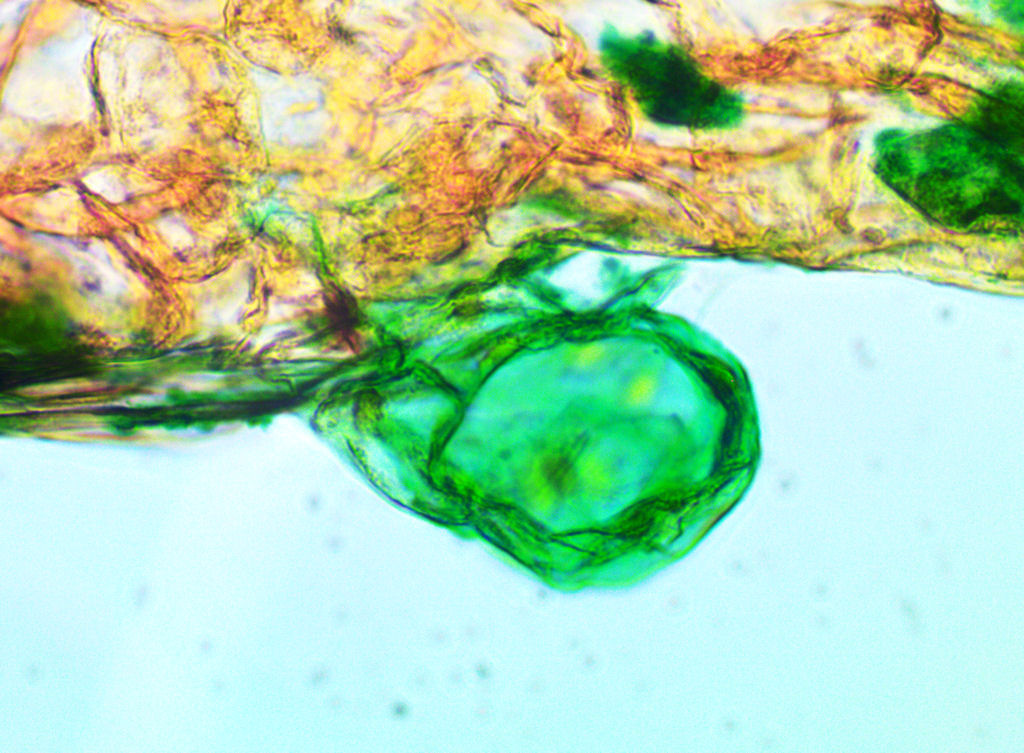
Bild 17: Mikroskopische Untersuchung nach 140 Tagen. Antheridium bei 320 x.
Dieser Test 2 begann am 11.05.2018 und läuft weiter, bis die Sporlinge pikierfähig sind.
Test 3, die 3. Generation Adventivprothallien - Adventiv von Adventiv von Adventiv
Es wurde eine neue Schale angesetzt und mit ungeteiltem, weißem Filterpapier belegt. 3 Adventhallien, ausschließlich von Polystichum × arendsii F² aus Test 2, wurden in möglichst kleine Stücke zerrissen und auf diese Fläche verteilt. Die folgenden Bilder zeigen den Entwicklungsverlauf.

Bild 18: Testschale 3 nach 45 Tagen.

Bild 19: Dieses Adventhallium ist auf Bild 18 links unten zu sehen. Es wurde wie dargestellt zerschnitten, danach die abgeschnittenen Flügel mit 2 Pinzetten in möglichst kleine Stücke zerrissen und auf die Fläche der neuen Anzuchtschale für Test 4 verteilt.

Bild 20: Testschale 3 nach 125 Tagen.
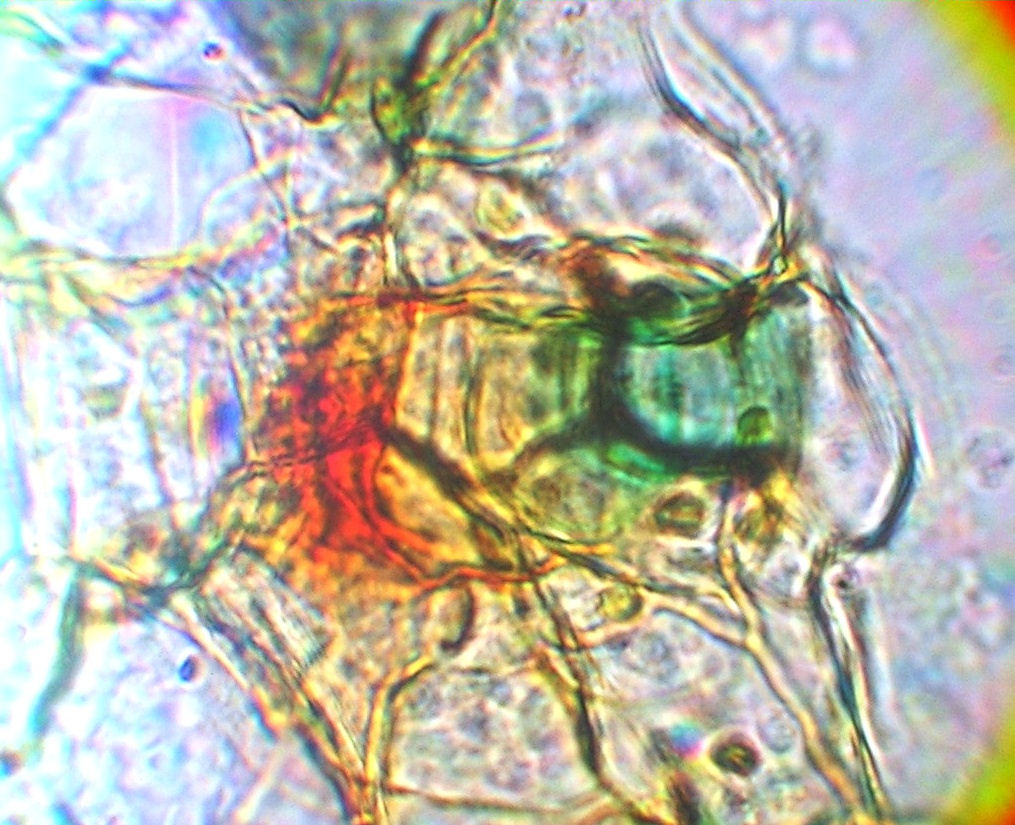
Bild 21: Mikroskopische Untersuchung nach 140 Tagen. Archegonium bei 320 x.
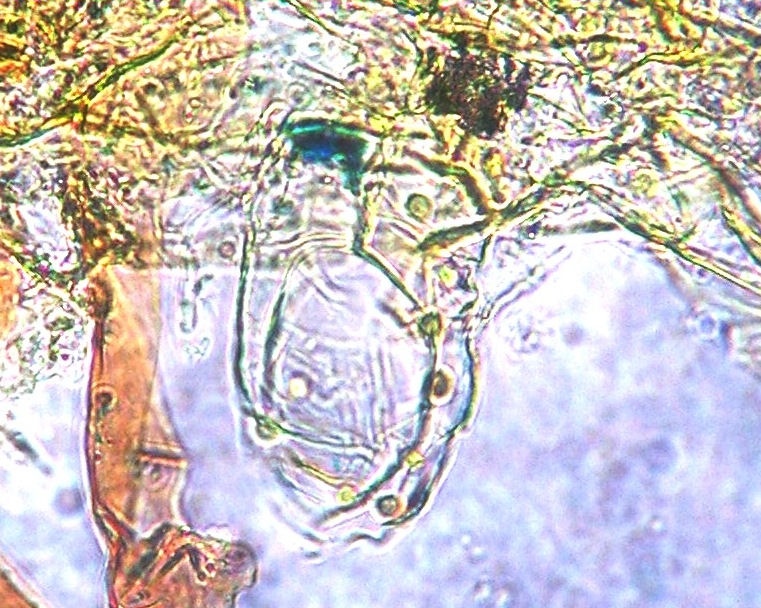
Bild 22: Mikroskopische Untersuchung nach 140 Tagen. Antheridium bei 400 x.

Bild 23: Testschale 3 nach 241 Tagen
Dieser Test 3 begann am 01.07.2018 und läuft weiter, bis die Sporlinge pikierfähig sind.
Test 4, die 4. Generation Adventivprothallien - Adventiv von Adventiv von Adventiv von Adventiv
Es wurde eine neue Schale wie in Test 3 beschrieben angesetzt. Nur ein Adventhallium von Polystichum × arendsii F² aus Test 3 wurde verwendet. Es ist im Test 3 auf Bild 17 links unten und auf Bild 18 zu sehen und dort beschrieben.
Die folgenden Bilder zeigen den Entwicklungsverlauf.

Bild 24: Testschale 4 nach 40 Tagen.

Bild 25: Testschale 4 nach 85 Tagen.
Das Prothallium unten in der Mitte wurde für die Mikroskopische Untersuchung geschnitten.
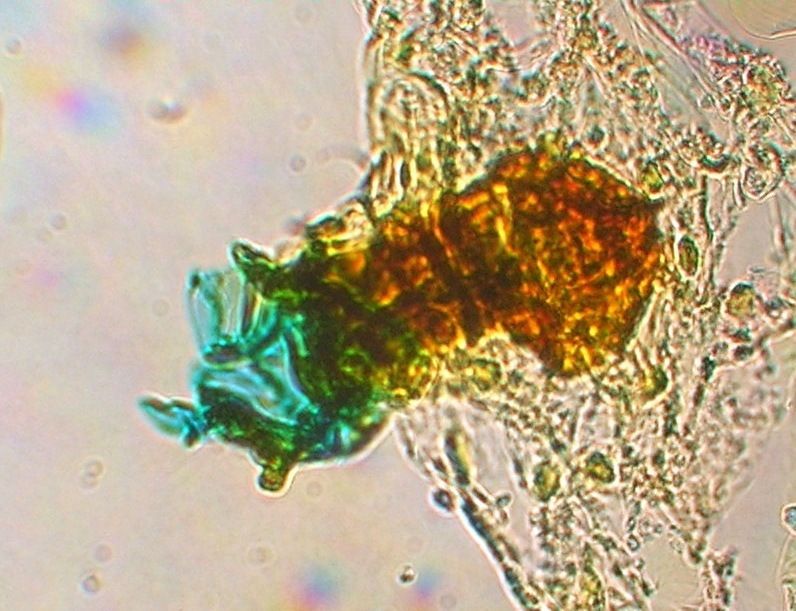
Bild 26: Mikroskopische Untersuchung nach 129 Tagen. Archegonium bei 320 x.
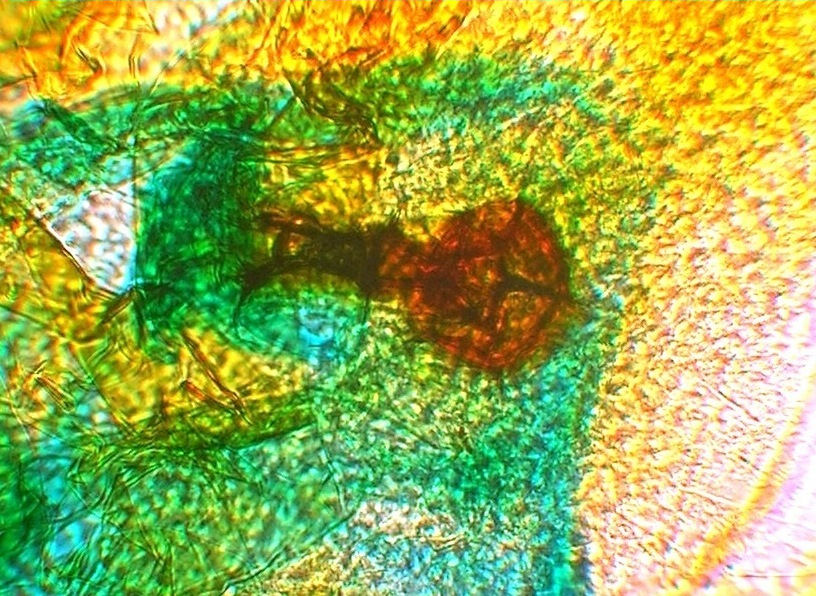
Bild 27: Mikroskopische Untersuchung nach 129 Tagen. Antheridium bei 320 x.

Bild 28: Testschale 4 nach 211 Tagen. Drei Prothallien wurden für mikroskopische Untersuchungen entnommen.
Wie man sieht, können aus einem einzigen Prothallium mindestens 12 entwicklungsfähige Adventhallien gewonnen werden.
Die ersten Sporophytenwedel beweisen, dass auch die 4. Generation Adventhallien normal vermehrungsfähig ist.
Dieser Test 4 begann am 24.09.2018 und läuft weiter, bis die Sporlinge pikierfähig sind. (Letzter Eintrag 18.04.2019).
Diskussion
Adventivprothallien, die sich an Gewebeteilen von Prothallien entwickeln, wenn man diese vom Scheitelmeristem getrennt hat, können nicht als apospor bezeichnet werden, Sie sind Regenerate eines Prothalliums, welches ja aus einer Spore entstanden ist. Daher sind sie mit den gleichen Gametangien ausgestattet wie das Ursprungsprothallium und somit sexuell.
Dass diese, bisher nur unter Laborbedingungen auf Agar beobachteten Vorgänge, auch unter gärtnerischen Bedingungen möglich sind, beweist mein Test.
Die für diesen Versuch verwendeten Ursprungs- Prothallien wurden aus Meiosporen gezogen, das heißt, sie waren mit rekombiniertem Erbgut ausgestatten. Die aus ihnen hervorgegangenen Adventivprothallien (Kurzform Adventhallien) tragen das gleiche haploide, rekombinierte Erbgut wie das zerstückelte Ursprungs- Prothallium, aber eben alle das gleiche. Welche Schlussfolgerungen sind daraus zu ziehen?
Es ist unerheblich ob die Adventhallien eines bestimmten Meioprothalliums sich selbst befruchten oder sich untereinander befruchten. Alle Sporophyten die aus diesen Verbindungen hervorgehen, sind vollständig homozygot und bilden einen Klon- Schwarm.
Hat das eine Bedeutung? Ich glaube nicht, denn diese Klone können wieder Meiosporen produzieren. Es ist nur eine weitere Möglichkeit für die Farnpflanzen, sich auch unter widrigen Umweltbedingungen zu behaupten. Zum Beispiel dass Prothallien nach einer Beschädigung nicht gleich verloren sind, sondern sogar noch verstärkt zur Vermehrung beitragen können. Der Ploidiegrad scheint dabei keine Rolle zu spielen. Das solche Situationen in der Natur nicht selten vorkommen, aber kaum beobachtet werden können, lässt sich denken.
Aus gärtnerischer Sicht kann man sagen, dass aus einem einzigen Prothallium innerhalb eines Jahres viele tausend Jungfarne gezogen werden können, ohne großen Aufwand und ohne auf Sporen angewiesen zu sein.
Zwischen zerschnittenen und zerrissenen Gewebeteilen konnte im Ergebnis kein signifikanter Unterschied festgestellt werden.
Die in der Anzuchtschale im Segment links unten ausgelegten Blätter von Erstlingswedeln des Polystichum setiferum `Dahlem´ zeigten während der 1. Testphase keine regenerative Neigung (siehe Bild 05). Es muss allerdings erwähnt werden, dass diese Wedel weitgehend unbeschädigt verwendet wurden. Ein Versuch mit zerschnittenen Wedeln im Test 2 war dagegen erfolgreich. Es bildeten sich allerdings nur wenige Prothallien.
Der Unterschied zu den regenerativ entstandenen Adventhallien ist natürlich gravierend, weil es sich hier um Adventhallien handelt, die an Sporophytenwedeln, also apospor, entstanden sind.
Hier könnte die Genexpression von Kormophyt auf Thallophyt eine hemmende Rolle spielen. Außerdem sind diese Adventhallien mindestens diploide. Sollten sie sich sexuell vermehren, entstehen zum Beispiel autotetraploide Farne.
Eine mikroskopische Untersuchung auf Gametangien soll in einem weiteren Test vorgenommen werden.
Ich danke Herrn Dr. Berndt Peters für Anregungen und kritische Durchsicht.
Gegenüberstellung Sporen - Pollen - Samen
Text: ©2014 Siegfried Piller
Worin unterscheiden sich Sporen von Pollen und Samen?
Diese oft gestellte Frage wird beantwortet durch Gegenüberstellung der generativen Vermehrung von Farnen und Blütenpflanzen.
Es werden nur die wichtigsten Entwicklungsschritte ohne Einzelheiten aufgeführt. Die Farben sollen bei der sinngemäßen Gegenüberstellung helfen, darum ist der Text im "Zickzack" zu lesen, nach Nummern.
| Standard-Blütenpflanzen (B) | Gegenüberstellung | gleichsporiger Farn (F) |
|
B01
B02
B03
B04
B06 |
Die Vorgänge B01 und F01 können als ähnlich bezeichnet werden. Vor der Bildung des mit dem Blütenmeristem vergleichbaren Prothallienmeristems in F03 erfolgt bei den Farnen die Meiose (Reduktionsteilung).
Die Prothallienmeristemzellen der Farne sind in ihrer Funktion mit den Blütenmeristemzellen der Blütenpflanzen vergleichbar.
Die Spore ist also eine überdauerungs- und verbreitungsfähige, omnipotente Meristemzelle.
B02 ist mit F04 vergleichbar. Der Unterschied; B02 ist diploide und mit der Ursprungspflanze fest verbunden. F04 ist haploide und unabhängig von der Ausgangspflanze. Das Ergebnis der Syngamie bei F04 ist nicht der Same, sondern die neue Pflanze.
Das Prothallium ist also, was seine Funktion anbelangt, so etwas wie die externe Blüte der Farnpflanzen.
B03 und B04 sind mit F05 und F06 vergleichbar. Der wichtigste Unterschied; Bei den Blütenpflanzen findet die Meiose für weibliche und männliche Gameten getrennt an der Blüte statt, bei den Farnen hat sie zu diesem Zeitpunkt schon im Sporangium stattgefunden.
Das Pollenkorn ist also der widerstandsfähige Transportbehälter für die Spermatozoiden der Blütenpflanzen.
Der Unterschied von B05 zu F07: Das Pollenkorn muss durch Fremdeinwirkung auf die Narbe einer Blüte gelangen und der Spermatozoid benötigt einen Pollenschlauch um zur Eizelle zu kommen.
Das Samenkorn ist also ein überdauerungs- und verbreitungsfähiges, vielzelliges Pflanzenembryo.
Die Verbreitung der Art geschieht also bei den Blütenpflanzen durch den fertigen Embryo, bei den Farnen durch die omnipotente Meristemzelle, aus der dann das externe, blütenähnliche Prothallium erwächst. |
F01 Vegetative Bindegewebezellen werden in generative Sporangienmeristemzellen umgebildet. Es entsteht ein Receptaculum (Plazenta) an der Unterseite des Farnblattes.
F02
F03
F04
F05
An heterosporen Farnen (Moosfarne, Brachsenkräuter und Wasserfarne) wachsen, wie an den Samenpflanzen, Micround Macrosporen getrennt. In diesen freigesetzten Sporen bilden sich Micro- (männliche) und Macro- (weibliche) Prothallien, welche aber stark reduziert sind und die Spore nicht verlassen. Die beweglichen Spermien der Microsporen finden, dank der Lockstoffe, die Eizelle in der Macrospore. Es entsteht aber kein Samenkorn sondern direkt eine neue Pflanze. Dieses wird als Übergangsform zu den Nacktsamern und weiter zur Entstehung der Blüten angesehen. |
Ich danke Herrn Dr. Berndt Peters für Anregungen und kritische Durchsicht.
Die Gattung Pyrrosia
Die Gattung Pyrrosia
Text & Fotos Ben van Wierst und viele andere
Im Jahr 2010 war ich mit einer Delegation des niederländischen Farnvereins und Mitgliedern der Fachgruppe Farne zu Besuch bei Christian Kohout im Osten Deutschlands. Es gab mindestens 800 bis 900 verschiedene Farne in seinem Garten. Eine der Arten, die Aufmerksamkeit erregte, war in meinen Augen die exotisch aussehende Pyrrosia sheareri. Ich wusste damals nicht, dass diese Art von Farn auch in unseren Gärten wachsen kann. Diese Pflanze wollte ich auch haben.
Es gibt Mitglieder der Farngesellschaften und -vereine, denen Pyrrosia-Arten unbekannt sind, da diese Pflanzen noch nicht oft kultiviert werden. Einer der Gründe ist das langsame Wachstum, das eine schnelle Verbreitung unmöglich macht. In der Farnliteratur finden wir nicht viel zu diesen Pflanzen. Peter Hovenkamp schrieb in der Varen Varia 31, 2018, Nr. 3 einen Artikel über die wissenschaftliche Erforschung dieser Gattung. Jetzt ist es Zeit für einen Artikel über Gartenerlebnisse, die wir mit diesen Pflanzen haben. Dafür habe ich die Erfahrungen verschiedener Liebhaber (Gartenstandorte in der Karte rechts) gesammelt und ausgewertet.

Pyrrosia „similis“ (Foto: Ben van Wierst)
Die Gattung Pyrrosia
Pyrrosia umfasst mindestens 50 Arten, die in Afrika, Asien, Australien und einer Reihe von Inseln im Pazifik verbreitet sind. Südostasien weist die meisten Arten und Formen auf. Pyrrosia ist also in erster Linie eine tropische Gattung. Es gibt keinen deutschen Namen für diese Farne. Pyrrosia werden im Englischen „Filzfarn“ genannt, weil sie auffallende Haare haben. Diese befinden sich sowohl unter als auch oben auf dem Wedel. Ein anderer englischer Name, den wir dem Asplenium scolopendrium bereits gegeben haben, ist „Zungenfarn“. Dieser Name bezieht sich auf das einfache Aussehen der meisten Pyrrosien: Sie haben nicht das typische Aussehen eines Farns mit mehrmals geteilten Blättern. Das Blatt ist oft sehr einfach geformt. Bei den Arten, die mit P. sheareri verwandt sind und hier unten diskutiert werden, sehen wir jedoch eine beginnende Teilung des Blattes. Die Blattform kann natürlich innerhalb einer Art variieren. Auf diese Weise kann Ähnlichkeit mit anderen Pyrrosia-Arten bestehen. Es gibt auch Sorten mit bizarren Formen, insbesondere von P. lingua in Japan.
Pyrrosien haben ein Rhizom, auf dem die Blattstiele dicht beieinander oder weiter auseinander stehen können. Dies führt zu dichten Polstern oder kriechenden Pflanzen.
Standorte in der Natur
Pyrrosia-Arten können an verschiedenen Orten in der Natur wachsen. Es gibt viele, die epiphytisch wachsen. Die Nährstoffe werden dann dem Humus entzogen, der sich z.B. in Moospolstern oder Astgabeln angesammelt hat. Andere wiederum sind Lithophyten, wachsen also auf Steinen oder Felsen. Und schließlich gibt es terrestrisch wachsende Vertreter der Gattung, die wie die meisten Pflanzen im Boden wachsen.
Klima Pyrrosia-Arten aus Asien wachsen manchmal in großen Höhen in den Bergen und kommen auch recht weit bis in nördliche Breitengrade vor, wie Fundorte in Nordchina, Japan, Korea und Sibirien (in der Nähe von Wladiwostok) belegen. Die Winter sind dort kalt. Dies erhöht die Chance, dass sie für unsere Gärten geeignet sind. Aber es gibt auch Überraschungen: Es gibt durchaus Pflanzen aus südlicheren Regionen, die auch in unseren Gärten wachsen können.
Trockenresistenz Aufgrund der Bedingungen am Naturstandort müssen Pyrrosien an Zeiten mit Wasserknappheit angepasst sein. Sowohl in Bäumen als auch auf Felsen kann schnell ein Wassermangel auftreten. Als Anpassung daran sind eine Reihe von Arten in der Lage, genau wie z.B. der Milzfarn (Asplenium ceterach) fast vollständig auszutrocknen. Die Pflanzen sehen dann zwar komplett dehydriert und verschrumpelt aus, erholen sich aber bei erneuter Feuchtigkeitszufuhr vollständig.
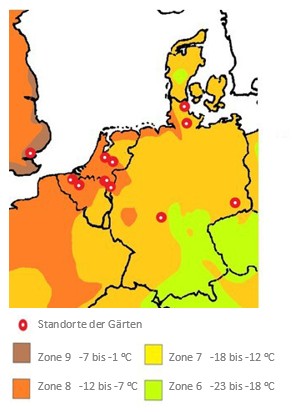
Standorte der Gärten aus der Umfrage, in denen die Pyrrosien wachsen.
Arten in unseren Gärten
Welche Arten gibt es in unseren Regionen in Gärten und wie sind die Erfahrungen der Besitzer? Dafür habe ich eine kleine Umfrage unter Enthusiasten gemacht, die diese Pflanzen besitzen. Ich habe mich nicht nur auf Mitglieder des Niederländischen Farnvereins beschränkt, sondern auch nach Erfahrungen in Deutschland und England gefragt, und interessante Erfahrungsberichte gesammelt (Abb. vorstehend). Die folgenden Pflanzen wurden von den Befragten erwähnt. Die ersten vier Arten sind alle mit P. sheareri verwandt.
Pyrrosia drakeana Dies ist eine fast typische Pyrrosia-Art mit einer einfachen ungeteilten Blattform. Es kann aber einfache kleine Lappen am Blattrand geben. Das Rhizom ist kurz und die Pflanze hat einen kompakten Wuchs. Das Blatt steht auf langen Stielen und die Gesamthöhe kann vom Rhizom bis zur Blattspitze 60 cm betragen. Diese Art ist P. sheareri manchmal ziemlich ähnlich. Liebhaber in den Niederlanden besitzen diese Pflanze noch nicht, in Nachbarländern wird sie aber erfolgreich im Freien gehalten. In Anbetracht des Ursprungsgebietes (bis zu einer Höhe von 3600 m über NN), der Verwandtschaft mit der nächst genannten Art, die im Garten gut kultiviertbar ist und der bisherigen guten Erfahrungen scheint es sich zu lohnen, diese Pflanze zu erwerben.

P. drakeana (Foto: Jos van Dyck)
Pyrrosia sheareri Im Handel in England sehr sporadisch zu bekommen. Dies ist auch die Art, die ich im Garten von Jörg Kohout in Ostdeutschland wachsen sah und mit der mein Interesse an der Gattung bei mir geweckt wurde. Im Winter vor unserem Besuch war es –28°C kalt gewesen! P. sheareri kommt in China, Taiwan und Vietnam vor und wächst dort in Höhen von 500 bis 2500 m. Die Art wächst hauptsächlich lithophytisch, kommt aber auch epiphytisch in Wäldern in weniger offenen Lagen vor. Trotz des südlichen Vorkommens dieser Art ist sie gut kälteresistent. Die Art ist eng mit der vorherigen verwandt und ist dieser sehr ähnlich. P. sheareri bildet meist ein kurzes Rhizom mit 20 bis 40 cm hohen Blättern. Der kräftige Blattstiel fällt auf und geht dann in eine markante Blattader über. Der Stiel ist im Verhältnis zum Blatt kürzer als der der vorhergehenden Art. Die Form der Blattscheibe kann je nach Pflanze variieren. Am Blattansatz können einseitig oder auch beidseitig Lappen vorhanden sein. Das Blatt von P. sheareri ist oft schmäler als das von P. drakeana. Wenn ich mir die Bilder beider Typen im Internet ansehe, habe ich den Verdacht, dass sie ab und zu verwechselt werden. Tim Pyner, der leider viel zu früh verstorben ist, hat auch eine Pflanze gemeldet, die unter dem falschen Namen aufgeführt wurde. Daher begann ich mich zu fragen, ob die Pflanzen von Kohout richtig benannt waren. Angesichts der in Tabelle 1 zusammengefassten Daten und von Fotos im Internet hatte er vermutlich P. drakeana im Garten. Es gibt mehrere gute Merkmale zur Unterscheidung der Arten, wie die Form der Haare auf der Blattoberfläche und die Form der Sori. (siehe Tabelle unten).
| Merkmal | P. sheareri | P. drakeana |
|---|---|---|
| Verhältnis Stiel- zur Blattlänge | 0,5-1 | 1-2 |
| Blattlänge (cm) | 9-50 | 5-25 |
| Verhältnis Pflanzenhöhe zu -breite | 3-7, meist 5-6 | 2-5, meist 3 |
| Behaarung (Indument) | einförmig, angedrückt | zweiförmig, zottelig |
| Haarlänge | 0,3-0,5 (bis 1) mm | (0,8 bis) 1,0-1,6 mm |
| Sori, wenn sie reif sind | überragen das Indument | innerhalb der Haare |
Unterscheidung von Pyrrosia sheareri und P. drakeana
Die Pflanze wird von einer Reihe von Mitgliedern in unserem Land und in den umliegenden Ländern erfolgreich im Freiland gehalten.

Pyrrosia sheareri (Foto: Claus Fredemann)

Blattformen im Vergleich: 1 P. drakeana 2 P. sheareri 3 P. hastata 4 P. polydactyla 5 P. subfurfuracea
6 P. porosa 7 P. lingua 8 P. petiolosa 9 P. linearifolia 10 P. rupestris 11 P. eleagnifolia
Pyrrosia hastata Diese Art stammt aus Japan und von einigen Stellen entlang der Küste Südkoreas. Sie wächst meist lithophytisch, manchmal auch epiphytisch in Wäldern in einer Höhe von 200 bis 400 m, möglicherweise aber auch höher.
Wie bei den vorhergehenden Arten ist die Form des Blattes nicht ganz einheitlich. Es scheint so zu sein, dass es eine Blattspreite gibt mit zwei größeren Nebenlappen, aber daneben können auch mehrere kleinere zusätzliche Lappen vorhanden sein. Dann kann P. hastata der Art P. polydactyla sehr ähnlich sein. P. hastata wird von 20 bis 40 cm groß. Die Pflanze hat einen kurzen Wurzelstock und kann als ältere Pflanze ein schönes Polster bilden. Auf der Blattoberfläche sind die feinen Haare bei P. hastata deutlich sichtbar und können der Pflanze ein filzartiges Aussehen verleihen.
Soweit bekannt, wird die Art in den Niederlanden noch nicht gehalten, aber die anderen Teilnehmer berichten von guten Ergebnissen. Ich selbst habe die Art eine Weile gehabt, habe sie aber wahrscheinlich zu spät im Jahr und möglicherweise auch an einen zu feuchten Ort in den Garten gepflanzt, so dass sie den folgenden strengen Winter nicht überstand.

P. hastata (Foto: Claus Fredemann)
Pyrrosia polydactyla Aus Taiwan in Höhen bis 2.100 m. Hier wächst sie epiphytisch, lithophytisch oder terrestrisch. Diese Art hat ebenfalls gelappte Blätter. Die Lappen sind jedoch länger als bei P. hastata. Der Name der Art bedeutet „mit vielen Fingern“. Sie wird etwa 20 bis 30 cm hoch. Im Unterschied zu P. hastata ist bei P. polydactyla die Ader am Übergang vom Stiel zur Spreite häufig dunkel gefärbt.
Einige der Befragten sind noch etwas vorsichtig, aber es sieht so aus, als könnte die Art problemlos in unseren Gärten gehalten werden. Bei Trockenheit und Kälte kräuseln sich die Blätter recht schnell.

Pyrrosia polydactyla (Foto: Ben van Wierst)
Pyrrosia × matsudae Ebenfalls aus Taiwan. Von Pyrrosia sind nicht viele Hybriden bekannt. Diese ist vermutlich die Kreuzung aus P. polydactyla und P. porosa. Sie hat sowohl die länglichen Wedel von P. porosa (siehe unten) als auch die gelappten von P. polydactyla. Pyrrosia × matsudae bildet aber sehr unregelmäßige Lappen.
Diese Form wird derzeit nur von einem Enthusiasten außerhalb der Niederlande kultiviert, über die Erfahrungen kann noch wenig gesagt werden.

P. × matsudae (Foto: Claus Fredemann)
Pyrrosia subfurfuracea Diese Art wächst gerne auf kalkhaltigem Gestein und kommt sowohl im Schatten als auch in voller Sonne vor. Manchmal wächst sie auch epiphytisch. Sie wächst in einer Höhe von 500 bis 2.000 m. Die Art hat normalerweise ein kurzes Rhizom. Die lanzettlichen Blätter können bis zu 80 cm lang werden. Neue frisch entrollende Blätter sind mit einer dicken Schicht „flaumiger“ Haare bedeckt. Die genannte Länge bezieht sich auf die abgebildete Pflanze von Claus Fredemann, die in einen Topf gepflanzt ist und größer wird als die Pflanzen in seinem Garten mit einer Höhe von nur 25 cm.
Drei Personen experimentieren mit dieser Art. Die Ergebnisse sind moderat. Die Art kann in unseren Gärten überleben, wächst aber langsam und braucht Winterschutz.

P. subfurfuracea (Foto: Jos Dyck)
Pyrrosia porosa ist auch unter den Synonymen P. davidii und P. gralla bekannt. Sie hat ein großes Verbreitungsgebiet von der östlichen Hälfte Indiens über China bis nach Japan und auf die Philippinen von 90 bis 2.600 m Höhe. Sie wächst hauptsächlich lithophytisch, wobei Kalkstein Granit vorgezogen wird, aber auch epiphytisch und terrestrisch und zwar an Orten, die Wind und Wetter ausgesetzt sind. Es handelt sich wieder um eine typische Pyrrosia mit einer einfachen, nicht gelappten Wedelform. Die Blätter sind etwa 10 bis 30 cm lang und lanzenförmig.
Die Art wird in den Niederlanden noch nicht gehalten, aber bei wenigen Farnfreunden in Deutschland und England. Die Pflanzen stehen draußen oder in einem ungeheizten Gewächshaus. Diese Liebhaber sind noch ein bisschen vorsichtig, aber Temperaturen von –12°C werden überlebt. Wenn man sich die Karte ansieht, sollte die Herkunft der Pflanzen auch dazu beitragen, dass sie im Garten erfolgreich wächst.

P. porosa (Foto: Claus Fredemann)
P. lingua ssp. lingua wächst hauptsächlich lithophytisch, seltener epiphytisch und manchmal terrestrisch, oft an offenen Standorten wie trockenen Felsen, Felsen an der Küste, offenen und trockeneren Wäldern. Sie wächst vom Meeresspiegel bis zu einer Höhe von 2.500 m. Sie hat ein kriechendes Rhizom und Wedel, die bis zu 30 cm groß werden können. Die getrocknete Pflanze wird in der chinesischen Kräutermedizin bei Erkrankungen der Blase und der Harnwege eingesetzt. Die Art ist in Japan als Kulturpflanze beliebt. Genau wie bei uns bei Polypodium und Polystichum setiferum sind viele Sorten mit manchmal bizarren Blattformen entstanden. Die meisten Pflanzen, die bei uns zirkulieren, sind wahrscheinlich japanische Sorten. Es gibt mehrere Mitglieder, die eine oder mehrere dieser Sorten besitzen. Das Foto von Jos Dyck von P. lingua ssp. lingua zeigt wahrscheinlich die Wildform der Pflanze. P. lingua ist die am meisten kultivierte Pyrrosia in unserer Farnvereinigung. Die meisten Erfahrungen werden wahrscheinlich mit P. lingua ssp. lingua gemacht. Diese sind sehr unterschiedlich. Das hat nichts mit dem Garten zu tun, in dem sich die Pflanze befindet, sondern vielmehr damit, wie sie gepflanzt wird und wahrscheinlich noch viel mehr mit dem Ursprung der Pflanze.
Die meisten Befragten beschreiben die Pflanze als zuverlässig winterhart. Andere weisen jedoch darauf hin, dass die Art im Garten etwas zu kämpfen hat. Auch mit ein- und derselben japanischen Sorte werden in derselben Region unterschiedliche Erfahrungen gemacht.

P. lingua ssp. lingua (Foto: Jos Dyck)
Pyrrosia lingua ssp. heteractis wächst eher in der Mitte des großen Verbreitungsgebietes von P. lingua ssp. lingua. Bei meiner ersten Begegnung mit dieser Unterart habe ich sie nicht als P. lingua erkannt. Es ist eine robuste Pflanze. Die beiden Unterarten sind schwer zu unterscheiden. Oft ist die ssp. heteractis mit breiteren Blättern etwas größer und hat eine abweichende Behaarung. Dadurch fühlt sich die Unterseite der Unterart heteractis filzig an. Die Unterart heteractis wurde in England erfolgreich im Freien getestet (Zone 8), aber wahrscheinlich ist die Pflanze für unsere Gärten weniger geeignet.

Pyrrosia lingua ssp. heteractis (Foto: Ben van Wierst)

Die behaarte Unterseite des Wedels vonP. lingua ssp. heteractis (Foto: Ben van Wierst)
Pyrrosia caudifrons ist laut Peter Hovenkamp ein Synonym für P. lingua. Er schreibt, dass sich die unter diesem Namen beschriebene Form nur geringfügig von der Standardform von P. lingua unterscheidet. Es gibt nur zwei Enthusiasten, die diese Art besitzen, von denen einer daran zweifelt, dass der Name korrekt ist. Die Kulturerfahrungen sind moderat und es scheint möglich, dass die Erfahrungen zu denen mit P. lingua passen.
Pyrrosia „similis“ Unter dem Namen Pyrrosia similis zirkuliert eine Pflanze innerhalb der Farnvereinigung, die möglicherweise die erfolgreichste Pyrrosie in unseren Gärten ist (Abb. 1, Seite 24). Dieser Pflanze geht es auch in meinem Garten gut. Es scheint mir die am schnellsten wachsende Art zu sein, die wir bisher kennen. Die Pflanze soll von einem Mitglied stammen, das sie von einer Gärtnerei in China erhalten hat. Genau wie P. lingua hat diese Art ein längliches kriechendes Rhizom. Das größte Blatt meines Exemplars war 9 cm groß und etwa 4,5 cm breit mit einem etwa 6 cm langen Stiel. Mit diesen Proportionen erscheint dieses Blatt etwas breiter als bei der normalen P. lingua. Ich habe Peter Hovenkamp ein Stück meine Pflanze geschickt, der dazu meinte: „Ich kann nichts anderes daraus machen als Pyrrosia lingua. Es ist völlig typisches Material.“
Pyrrosia petiolosa Diese Art wird wahrscheinlich noch nirgends kultiviert. P. petiolosa kommt in einem großen Teil Chinas, Koreas und weiter nördlich bis zum südöstlichen Sibirien vor. Sie tritt also in Gebieten auf, in denen fünf Monate im Jahr Frost herrscht. In Berggebieten steigt die Art bis zu 2.000 bis 3.000 m hoch. Das Rhizom ist länger und kriechend. Es gibt einen gewissen Unterschied zwischen fertilen und sterilen Blättern: Die Wedel, die Sporen bilden, bleiben etwas kleiner als die nicht-sporentragenden. Diese Art ist weitgehend an einen steinigen Untergrund gebunden und wird auf Felsen und Mauern gefunden, oft der Sonne ausgesetzt. Sie wächst aber manchmal terrestrisch an geschützten Orten im Wald, nur selten als Epiphyt. Aufgrund ihrer Herkunft scheint diese Art sehr gut für unsere Gärten geeignet zu sein. Es gibt jedoch nur einen Enthusiasten, der berichtet, dass er diese Art besitzt. Dieser Farnsammler ist noch vorsichtig, weil die Pflanze bislang nur in einem Topf wuchs. Ein zweiter Enthusiast schreibt, dass er unter diesem Namen zwei Pflanzen aus China erhalten habe und beide eingegangen seien. Es scheint mir auf jeden Fall einen Versuch wert zu sein, diese Art auszuprobieren.

P. petiolosa (Foto: Petr Voboril)
Pyrrosia eleagnifolia Diese neuseeländische Art wird in ihrer Heimat leather-leaf fern genannt und wächst normalerweise epiphytisch oder lithophytisch, gelegentlich auch terrestrisch. Der Standort kann sowohl geschützt als auch offen sein, oft an felsigen Küsten. Passend zu diesen Standorten ist diese Art gut dürreresistent. Diese Art hat ein lang kriechendes Rhizom mit zwei Formen von Wedeln. Die Spreiten sind etwa 10 bis 12 cm groß lang und nicht breiter als 2, maximal 3 cm. Sterile und fertile Wedel lassen sich unterscheiden.
Zwei Teilnehmer haben gute Erfahrungen mit dieser Art gemacht. Einer von diesen vermutet allerdings, dass P. eleagnifolia ein Synonym für P. rupestris ist. Laut der Literatur ist dies jedoch nicht der Fall. Wir wissen jedoch nicht, welche Art sich im Garten des Enthusiasten befindet. Aber bei dem derzeitigen Stand ist jede Pyrrosie nur willkommen und kann neue Erfahrungen bringen.

P. eleagnifolia (Foto: Ben van Wierst)
Pyrrosia rupestris kommt im Gegensatz zu den vorigen Arten, die aus Nordostasien stammen, von der Ostküste Australiens. Wie der Name rupestris (auf Felsen lebend) sagt, wächst sie gern auf Steinoberflächen (Basalt, Granit und Sandstein). Aber sie wird auch als Epiphyt gefunden, sowohl im Tieflandregenwald als auch auf Berggipfeln bis zu einer Höhe von 1.150 m.
Bei einem ausländischen Enthusiasten befindet sich die Pflanze in einem ungeheizten Gewächshaus und hat dort –12 ° C überlebt.

Pyrrosia rupestris (Foto: Claus Fredemann)
Pyrrosia linearifolia Vorkommen von Taiwan im Norden bis nach Japan und Korea und in die chinesische Provinz Jilin, die für ihre kalten Winter bekannt ist. Die Art kommt jedoch nur bis zu 1400 m Höhe vor. Es ist eine Art mit einem langkriechenden Rhizom, auf dem die Blätter manchmal nahe beieinander stehen können. Die Blätter werden ungefähr 10 cm groß und sind lanzenförmig. Die Pflanze kann mit vielen Blättern dicht nebeneinander auf Felsen oder Bäumen gefunden werden. Diese Art wird von einem Befragten erwähnt, mit der Einschränkung, dass sie nicht erfolgreich kultiviert wird. Ich möchte die Art trotzdem erwähnen. Sie hat ein großes Verbreitungsgebiet und kommt in der Provinz Jilin vor, von der Wikipedia nur wenig zu berichten weiß, außer dass es einen sehr kalten Winter gibt. Vielleicht sollte man die Pflanze an verschiedenen Stellen im Garten ausprobieren.
Bedingungen im Garten
Die meisten Pflanzen aus dieser Studie wachsen in Gärten mit sandigen Böden. Einige Gärtner verbessern ihren Boden mit humusreichen Zusätzen, aber auch mit Kies und Schotter, die die Entwässerung verbessern. Einige Liebhaber berichten, dass sie ihre Pyrrosien an einem geschützten Ort überwintern, vor Kälte und vor starkem Wind geschützt. Das scheint auch vernünftig zu sein. Viele Arten leben in Wäldern und man kann davon ausgehen, dass sie dort keinen kalten Winden ausgesetzt sind. In den meisten Fällen werden die Pflanzen terrestrisch kultiviert. Viele Arten wachsen in der Natur aber auf Bäumen und Steinen. Dort wächst das Rhizom direkt auf der Oberfläche von Holz oder Stein und ist nicht bedeckt. Irgendwo habe ich die Warnung gelesen, dass eine Bedeckung des Rhizoms von Epiphyten und Lithophyten sie zum Faulen bringen kann.
In der Literatur werden die Bodenbedingungen am Naturstandort meist als sauer beschreiben, lediglich Arten wie P. porosa und P. subfurfuracea verlangen Kalkböden Dies sollte im Garten unbedingt berücksichtigt werden! Sämtliche Befragte halten ihre Pflanzen etwas trockener. Dies ist angesichts der Wachstumsstandorte und der Fähigkeit vieler Arten, Dürreperioden zu überstehen, sicher angebracht.
Vermehrung
Rhizomteilung Pyrrosien kann man durch Teilen des Rhizoms vermehren. Dabei ist wichtig, dass die beiden Teilstücke gleichgroß belassen werden, damit beide überleben und weiter wachsen können. Die meisten Arten wachsen sehr langsam.
Sporenaussaat Auf der Unterseite des Wedels finden sich die Sporen (Sori). Die fertilen Bereiche können sich in ihrer Größe unterscheiden. Sie können die gesamte Unterseite oder nur einen Teil bedecken, zum Beispiel nur die obere Hälfte des Wedels. Laut Sue Olsen werden die Sporen von P. sheareri im Winter reif und die reifen Sporen werden als gelbes Pulver unter dem Blatt sichtbar. Dieses kann ich bestätigen: Im Dezember 2019 lag eine dünne braune Schicht unter dem fertilen Wedel meiner P. lingua/similis.

Sporen an an der Unterseite der Wedel von P „similis“ (P lingua) (Foto: Ben van Wierst)
Was das Sammeln der Sporen schwierig macht, ist die dichte Bedeckung mit kurzen Haaren unter dem Blatt bei einer Anzahl von Pyrrosia-Arten. Dies erfordert eine Lupe und eine regelmäßige Überprüfung, um festzustellen, ob die Sporen bereits reif sind. Wenn die Sporen reif sind und die Blätter entnommen sind, kommen manchmal beim Trocknen neben Sporen auch viele Haare frei. Um dann die reinen Sporen zu erhalten, erfordert es häufiges Sieben und Reinigen, um die Haare zu entfernen. Sporen finden sich nicht oft an unseren Pflanzen im Garten. Das könnte an den Wachstumsbedingungen der Farne liegen. In einem Garten, in dem P. lingua/similis über Steine wuchs, bildeten sich auf mehreren Blättern gleichzeitig Sori. Wahrscheinlich ist dies weniger ein Glücksfall, sondern eher die Annäherung an die richtigen Wuchsbedingungen. Diese ersten Sporen der Art wurden auf der Sporenliste der niederländischen Farnvereinigung 2019 angeboten.
In der Vergangenheit wurden in den Niederlanden ein- oder zweimal Sporen von Pyrrosia-Arten angeboten. Die grundlegende Erfahrung aller Leute, die Pyrrosia-Sporen ausgesät haben, lautet, dass man geduldig sein muss. So habe ich es auch erlebt. Im Frühjahr 2015 habe ich Sporen von P. sheareri gesät, die ich von der englischen Farngesellschaft BPS erhalten habe. Eine schöne grüne Schicht Prothallien erschien. Die ersten Farne, die daraus hervorgingen, erwiesen sich jedoch als eine andere Art, nämlich Dryopteris dickinsii ‘Crispa’. Als ich diese Pflanzen entfernte, blieben viele Prothallien übrig. Aus diesen wuchsen schließlich eine Reihe von P. sheareri. Mitte 2018 bekam ich sechs Pflanzen aus diesem Sporenansatz von ca. 1 cm Größe . Diese wuchsen jetzt sehr langsam in einem Kleingewächshaus auf der Fensterbank. Die übrigen Prothallien wurden an Wouter van Driel abgegeben. Hier wachsen die Prothallien professioneller unter günstigeren Umständen weiter. Aber auch dort geht es relativ langsam. Wouter bemerkte, dass diese Art deutlich langsamer wächst als P. lingua. Wouter nahm an, dass die jungen Pyrrosien schneller wachsen, sobald sie in einzelne Töpfe gepflanzt sind. Ich habe meine Pflanzen im April 2019 in einzelne Töpfe gepflanzt und sofort begannen sie zügiger zu wachsen. Sind das die richtigen Bedingungen für eine „schnelle“ Kultivierung von Pyrrosia? Gutes Licht scheint eine wichtige Voraussetzung zu sein. Wouter kann es sich als gewerblicher Züchter nicht leisten, dass Pflanzen zu langsam wachsen. Er hat mit Licht experimentiert und verwendet jetzt spezielle Beleuchtung. Dies ergibt gute Ergebnisse. Die richtige Luftfeuchtigkeit scheint auch wichtig zu sein. Ein Gärtner gibt an, dass er seine jungen Pyrrosien lieber mit Wasser besprüht als gießt. Er sorgt auch für ein sehr luftig dräniertes Substrat mit viel Rinde, Lava und Kies. Einige Pflanzenzüchter verwenden auch Dünger wie Phostrogen (NPK 16-10-24), bei der Anzucht ihrer Jungpflanzen. Die Dosierungsempfehlung reicht dabei von der Hälfte der empfohlenen Dosierung, bis zu „eine Prise zwischen Daumen und Zeigefinger pro Liter Wasser“ oder sechs Tropfen pro Liter bei der Düngung der Prothallien. Nachdem die Jungfarne pikiert wurden, werden sie mit einer Düngelösung mit Phostrogen und Palmbooster besprüht.

P. sheareri, drei Jahre alte Jungpflanzen (Foto: Ben van Wierst)

Dieselben Pflanzen im Alter von fünf Jahren (Foto: Ben van Wierst)
Verfügbarkeit
Soweit ich weiß, werden Pflanzen in den Niederlanden selten zum Verkauf angeboten, in England gelegentlich. Ich selbst habe bisher keine Pflanzen im Internet gekauft. Ich sah zwar attraktive Pflanzen in den Angeboten, aber die Preise waren immer sehr hoch. Es kommt auch vor, dass der Preis der Pflanze selbst angemessen ist, aber die Versandkosten zu hoch sind. Daher beschränke ich mich hauptsächlich auf Pflanzen, die ich von anderen Sammlern bekomme. Und wenn ich die Chance bekomme, werde ich definitiv wieder Sporen aussäen.
Dank
Dieser Artikel wurde ursprünglich in der niederländischen Zeitschrift Varen Varia 32, 2019, Nr. 1–3 veröffentlicht.
Ich möchte mich bei den anderen Farnliebhabern bedanken, die ihre Erfahrungen mit mir geteilt haben. Dies sind in zufälliger Reihenfolge: Jos Dyck, Claus Fredemann, Berndt Peters, Rens Huibers, Remko Beuving, Bart Hendrikx, Fons Slot, Harry Roskam, Hermann de Swert, Filip Wauters, Wolfram Gassner, Berry Schut und Wouter van Driel. Ich habe auch die Daten des verstorbenen Tim Pyner verwendet und mich mit Peter Hovenkamp beraten. Aus dessen Monografie habe ich auch viele Daten verwendet. Danke auch an Petr Voboril (www.pinuli.net).
Als dieser Artikel in der Zeitschrift Varen Varia veröffentlicht wurde, erreichte mich die Nachricht, dass Peter Hovenkamp während einer Exkursion auf Sarawak, Malaysia, verunglückt war. Bevor ich diesen Artikel schrieb, konsultierte ich Peter vielmals. Auch habe ich viele Informationen aus seiner Monografie der Farngattung w verwendet. Ohne seine Beiträge hätte ich diesen Artikel nicht schreiben können.
Literatur und Quellen (Auswahl)
Hoshizaki & Moran. Fern Growers Manual
Hovenkamp, Peter. A Monograph of the Fern Genus Pyrrosia
Hovenkamp, Peter. Mijn leven met Pyrrosia Varen Varia Vol. 31 Nr. 2018 -3
Olsen, Sue. Encyclopaedia of Garden Ferns
Stuart, Tom. Pyrrosia. Fiddlehead Forum Vol. 35 Nr. 2 & 3, 2008
Stuart, Tom. Rock Garden Ferns.The Trillium Vol. 18 Nr. 3, 2008




